Para a segunda lei da termodinâmica, a entropia é a grandeza que está destinada a estudar a desordem das partículas. Ou seja, seu grau de agitação ou movimentação.
Nos estudos da termodinâmica, usamos a letra S para representar essa grandeza física. Na fórmula geral de variação de entropia, temos que S – So é equivalente a Q (quantidade de calor) / T (temperatura).
A partir desse sistema e daquilo em que a segunda lei da termodinâmica foca, essa área da física está interessada nas trocas de calor e seus efeitos sobre os corpos. Entenda melhor sobre entropia a seguir.
Um experimento para entender a entropia e a desordem
Como foi dito, a entropia estuda o grau de agitação ou desordem das partículas. Porém, essa desordem não significa bagunça, sendo que é apenas uma forma de organização do sistema, e não julgamos as organizações como positivas ou negativas dentro da física.
Afinal, esse não é o campo de observação principal. O interesse aqui é analisar como as partículas se comportam dentro de seu sistema, afim de observar as trocas de energia que acontecem entre elas e, também, a variação da entropia.
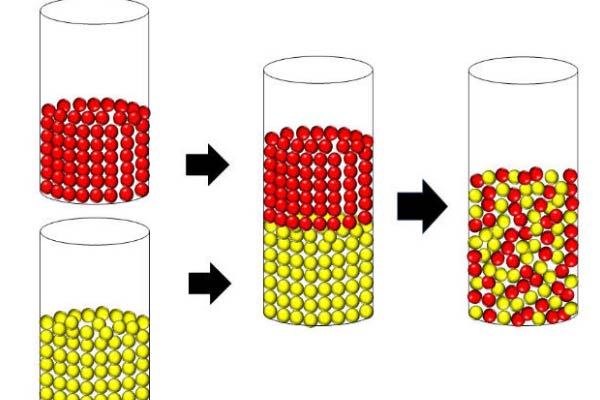
A partir disso, existem alguns experimentos bem simples que você pode experimentar para entender como é um sistema desorganizado e avaliar sua entropia.
Primeiro, separe dois potes, de preferência iguais, e encha os dois com bolinhas de gude coloridas. Tome o cuidado de deixar uma cor em cada pote, acabando com um pote com bolinhas escuras e outro pote com bolinhas claras, por exemplo.
Então, junte as aberturas dos dois potes, deixando um deles ao contrário sobre o outro. Observe que as bolinhas de gude permanecem em sua organização original, as escuras separadas das claras.
Para fazer essas bolinhas se agitarem, balance os potes sem separá-los, e isso vai fazer com que as bolinhas de gude se misturem. Então, observe novamente a organização das bolinhas, e perceba o quão difícil seria continuar mexendo os potes até que elas voltassem para a organização original.
Nesse sistema, ao aumentar a desordem das bolinhas a entropia também aumentou. Ou seja, podemos afirmar que a variação de entropia é positiva nos potes com bolinhas de gude.
Surgimento da entropia
Foi o pesquisador francês Nicolas Sadi Carnot que começou a desenvolver o conceito mais próximo de entropia, mas foi apenas em 1865 que Rudolf Clausius usou pela primeira vez o termo com a sua definição completa, criando a fórmula matemática para a variação de entropia.
Ele também definiu que a variação de entropia seria dada em J/K, sendo que a quantidade de calor transferida (Q) estaria em Joules e a temperatura (T) estaria em Kelvins, de acordo com o sistema internacional.
Segunda lei da termodinâmica
A segunda lei da termodinâmica, estruturada por Sadi Carnot, estuda a irreversibilidade dos fenômenos físicos de troca de calor. Carnot avançou seus estudos observando as máquinas térmicas.
A partir dessa observação, ele constatou que a troca de calor sempre ocorria das estruturas mais quentes para as mais frias, e pode confirmar que as trocas sempre seguem esse fluxo.
Por fim, ele constatou que o trabalho depende de energia térmica, pois era a partir da transferência de calor que as máquinas conseguiam produzir trabalho no fim da sequência.
Assim foi criado o ciclo de Carnot, que comprova que enquanto existe uma parte trabalhando com altas temperaturas, do outro lado existe a outra parte trabalhando com temperaturas mais baixas.
Dessa forma, o trabalho pode ser gerado nos dois sentidos. Um exemplo de sistema que absorve calor são os motores. E, ainda, um exemplo de sistema que perde calor são os refrigeradores.
Forças associadas à entropia
A força entrópica, assim chamada, existe como prova de que um sistema sempre tende a permanecer ou voltar ao seu estado de desordem, onde há maior entropia. Aqui estão alguns exemplos:
Polímeros
A força elástica dos polímeros é uma espécie de força entrópica pois, em seu estado relaxado, as partículas de um polímero estão desorganizadas. Assim, ao esticar um pedaço de borracha, as partículas se alinham, criando uma força para relaxar novamente.
Força hidrofóbica
A força hidrofóbica também representa uma força que reúne as partículas em um estado de desorganização. Isso porque, quando as moléculas de água são liberadas, ocorre um aumento de entropia no sistema.
Gravidade
A gravidade já foi considerada uma força entrópica pela física, mas existem controvérsias.
Portanto, de acordo com as definições e características da entropia, pode-se concluir como sua história está relacionada com as máquinas térmicas, a segunda lei da termodinâmica e muitos outros estudos antigos, mas que trouxeram grandes descobertas no mundo da física e das ciências.








Comentar