A química do universo é realmente algo surpreendente. Entender sobre átomos, elétrons, nêutrons e prótons faz com que enxerguemos o mundo com outros olhos. O mundo subatômico nos mostra que tudo está intrinsecamente conectado e que tudo no mundo é formado por átomos dos elementos químicos da tabela periódica. Átomos esses que formam moléculas que através das ligações químicas formam o nosso universo.
A química da natureza é estudada há séculos e desde as suas primeiras teorias até os estudos de hoje muita coisa foi desbancada. Não só na química, mas todas as ciências tiveram teorias rechaçadas com o advindo de novos pensadores e tecnologias que provavam as afirmações.
O estudo das ligações químicas é algo complexo, já que entender de fato o mundo subatômico não é tarefa fácil. Mesmo com toda a tecnologia que temos hoje é muito difícil observar todos os detalhes e forças envolvidas.
Mas, entender a química olhando tudo “um pouquinho mais de longe” torna o estudo mais simples e de fácil compreensão.
Está precisando entender sobre as ligações químicas? Aqui você vai entender sobre a teoria do octeto e todos os tipos de ligações químicas que os átomos e moléculas realizam.
Ligação Química: Teoria do Octeto
Antes de explicar sobre a ligação química em si é preciso entender uma teoria fundamental da química: a teoria do octeto.
Primeiramente, vamos lembrar que um átomo é composto por prótons, elétrons e nêutrons. Os prótons e os nêutrons formam o núcleo do átomo, que é a parte mais densa e compacta. Já os elétrons ficam ao redor do núcleo, transitando em constante movimento.
O núcleo do átomo tem uma carga positiva e os elétrons têm uma carga negativa por convenção.
Segundo o modelo Rutherford-Bohr, o núcleo do átomo é rodeado por órbitas circulares (como se fossem linhas imaginárias) e cada órbita possui um nível de energia. Os elétrons não transitam aleatoriamente ao redor dos prótons e nêutrons, mas, sim, ao decorrer dessas órbitas com uma trajetória circular.
Cada órbita tem a sua “quantidade de energia” específica e para que o elétron fique estável naquela “linha” ele precisa ter a quantidade de energia adequada.
Existem 7 camadas ao redor do núcleo: camada K, L, M, N, O, P e Q. Cada uma possui uma quantidade máxima de elétrons na sua camada, sendo, respectivamente 2, 8, 18, 32, 32, 32, 18 e 8.
A ligação química que um átomo realiza com o outro está extremamente relacionada com essa distribuição de elétrons. Cada elemento da tabela periódica possui um número atômico (número que representa quantidade de prótons) que equivale ao número de elétrons se a partícula estiver neutra.
O número de elétrons é distribuído pelas camadas sequencialmente e o “número que sobrar” representa o número de elétrons na última camada. Os elétrons da última camada da órbita são os que interagem com os outros átomos.
Vamos para um exemplo para tudo ficar mais claro. O oxigênio tem 8 prótons e 8 elétrons quando estável, então a distribuição seria a seguinte: 2 elétrons na camada K e 6 elétrons na camada L (2+6=8). Esses 6 elétrons que irão interagir com outras partículas.
O átomo sempre irá buscar ter 8 elétrons na última camada, isso é o que proporciona a ele estabilidade e por esse motivo ele interage com outros átomos.
Vale ressaltar que tudo descrito aqui é uma visão mais geral e simplificada do mundo subatômico, como a metodologia de ensino médio das escolas.
Ligação química: ligação iônica
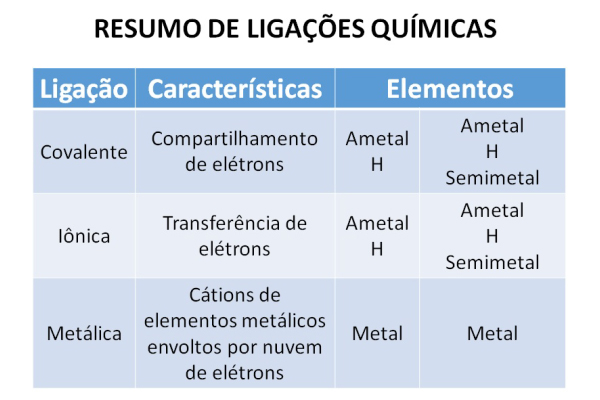
A ligação química tipo iônica é uma ligação que ocorre entre cátions (partículas com deficiência em elétrons) e ânions (partículas com excesso de elétrons).
Esse caso é o mais “ideal”, pois existem átomos que precisam de elétrons (cátions) e átomos que querem doar elétrons (ânions). Os dois átomos interagem e formam uma nova partícula.
Essa relação acontece entre elementos metálicos e não metálicos ou metálicos mais hidrogênio.
Vamos a um exemplo para visualizar tudo melhor: o sódio é encontrado na forma de Na+ (tem um elétron a menos na última camada) e o cloro na forma de Cl– (um elétron a mais). Os dois se unem e ambos se estabilizam com 8 elétrons na última camada.
Ligação química tipo covalente
Na ligação química tipo covalente não ocorre a perda e ganho de elétron como o caso da ligação iônica, mas sim o compartilhamento.
Isso ocorre porque os átomos têm a mesma necessidade de ganhar elétrons, então ambos se completam. Mais subatomicamente, é como se o elétron ficasse se alternando de átomo para átomo a ponto de parecer constante.
A ligação covalente ocorre na sua grande maioria entre átomos não metálicos que têm deficiência em elétrons.
Como exemplo, vamos utilizar a molécula de água, a H2O (duas moléculas de hidrogênio e uma molécula de oxigênio). Já relatamos que o oxigênio possui seis elétrons na última camada, o hidrogênio tem apenas um.
Ou seja, para o oxigênio se estabilizar ele precisa de dois elétrons, então ele associa-se com dois átomos de hidrogênio. Acontece que o hidrogênio não pode doar seu elétron, então eles compartilham ao mesmo tempo.
Ligação química tipo metálica
A ligação química tipo metálica acontece entre elementos metálicos como Ouro (Au), Prata (Ag), Cobre (Cu), Ferro (Fe), Alumínio (Al), Chumbo (Pb), Zinco (Zn), Níquel (Ni), etc.
Os elementos metálicos têm muita tendência a perder elétrons, se transformando em cátions. Esses elétrons liberados formam a chamada “nuvem eletrônica” ao redor do átomo, que se torna o meio de interação com os outros átomos.
Esses três tipos de ligações químicas são as reações que ocorrem entre os átomos, que interagem e formam moléculas. As moléculas também reagem entre si e com as sucessivas ligações as coisas do universo começam a tomar forma.
Estudar a tabela periódica é uma boa forma de entender como os átomos interagem entre si. Os elementos não estão dispostos aleatoriamente, mas são divididos em classes com características semelhantes (número de elétrons, raio, massa, etc.). Entendê-la facilita associações.
As ligações químicas são uma das bases da constituição do nosso universo e conhecê-las é importante, mesmo que seja por simples curiosidade. Aprenda mais em Vou Passar.Club







Comentar